రసాయన శాస్త్రములో పేర్లు
చరిత్ర
[మార్చు]“వాగర్థా వివసంపృక్తౌ వాగర్థాప్రతిపత్తయే, జగతః పితరౌ వందే పార్వతీపరమేశ్వరౌ”
అన్నాడు కాళిదాసు, రఘువంశం మొదలుపెట్టే ముందు. ఒక మాటకీ ఆ మాట అర్థానికి మధ్య పెనవేసుకున్న బంధం ఎటువంటిదో పరిపూర్ణంగా ఆకళింపుకి రావాలంటే ఈ అద్భుతమైన శ్లోకంలోని పదచిత్రం అర్థం చేసుకోగలిగే సమర్ధత ఉండాలి. ఆధునిక శాస్త్రంలో ఒక మాటకీ ఆ మాట అర్థానికి మధ్య పెనవేసుకున్న బంధం చాల ముఖ్యం. ఆ మాటకొస్తే "భావాలకి పేర్లు పెట్టడమే శాస్త్రం" అని కొందరి అభిప్రాయం.
రసాయన శాస్త్రం లోని మౌలిక భావాలకి ఎంత ప్రాముఖ్యత ఉందో ఆ భావాలకి పేర్లు పెట్టడంలో ఉన్న కష్ట సుఖాలకీ అంతే ప్రాముఖ్యత ఉంది. దీనికి కారణం లేక పోలేదు. శాస్త్రంలో భావానికీ ఆ భావాన్ని వెలిబుచ్చే మాటకీ మధ్యనున్న లంకె చాల ముఖ్యం. మాట అర్థం కాకపోతే భావం అర్థం కాదు. భాషలో పట్టు లేకపోతే మాట అర్థం కాదు.
ఒక పదార్థానికి అనాదిగా వాడుకలో ఉన్న పేరొకటి, రసాయనశాస్త్రం శైశవ దశలో ఉన్నప్పుడు, మిడిమిడి జ్ఞానంతో పెట్టిన పేరు మరొకటి, ఒక బణువులో అణువుల అమరిక అర్థం అవుతూన్న రోజుల్లో అదే పదార్థానికి పెట్టిన పేరు ఇంకొకటి, జినీవా ఒప్పందం ప్రకారం పెట్టిన తర్కబద్దమైన నామధేయం మరొకటి. ఇవన్నీ చాలనట్లు తెలుగు పేర్లు పెడదామన్న ఉత్సాహంతో, మనం స్వకపోలకల్పితాలుగా పెట్టిన పేర్లు మరికొన్ని! ఈ ప్రయత్నాలన్నిటికీ కారణం ఒక మాటకి, ఆ మాట అర్థానికి మధ్య పెనవేసుకున్న బంధం యొక్క ప్రాముఖ్యత.
రసాయనాలకి పేర్లు పెట్టే తతంగం అంతా ఒక ఎత్తు, ఆ పేర్లు మరచిపోకుండా గుర్తు పెట్టుకోగలగడం మరొక ఎత్తు. కర్బన రసాయనపు పరిధిలో ఉన్న పదార్థాల సంఖ్య కోటికి పడగలెత్తకపోయినా లక్షలలో ఉన్న మాట వాస్తవం. ప్రతి ఏటా కనీసం వెయ్యికి పైగా కొత్త రసాయనాలు కనిపెడుతున్నారు. వాటికి నోరు తిరగని పేర్లు పెడుతున్నారు. వీటన్నిటికీ ఒక వరసా, వావీ, వైఖరీ, విధానం లేకుండా పోతే కొమ్ములు తిరిగిన వారికే వెర్రెత్తే ప్రమాదం ఉంది. అందుకనే ఇక్కడ పేర్ల ప్రస్తావన.
అనాంగిక రసాయనాలు
[మార్చు]శాస్త్రం అంటే నిర్దిష్టమైన భావాలకి నిర్దిష్టమైన పేర్లు పెట్టటం. ఈ పెట్టే పేరు కూడా నిర్ద్వందంగా ఉండాలి. ఆ పేరు వినగానే ఆ రసాయనం ఏమిటో అనుమానానికి ఆస్కారం లేకుండా తెలియాలి. ఒకే పదార్థానికి ఒకటి కంటే ఎక్కువ పేర్లు ఉంటే పరవా లేదు కాని ఒక పేరు పెట్టి పిలిచినప్పుడు ఒకే ఒక్క రసాయనం పలకాలి.
చిన్న ఉదాహరణలతో మొదలు పెడదాం. ప్రాణవాయువు, ఆమ్లజని, ఆక్సిజన్ అన్న మూడు పేర్లు ఉన్నాయి. ఇవన్నీ ఒకే రసాయన పదార్థాన్ని సూచిస్తాయి. ఈ పదార్థానికి ఇతర భాషలలో ఇంకా ఇతర పేర్లు ఉండొచ్చు. ఎవరేమి పేరుతో పిలిచినా పలికేది ఒకటే. సౌలభ్యం కొరకు అంతర్జాతీయంగా జరిగిన ఒప్పందం ప్రకారం ఈ పదార్థానికి “O” అనే పొట్టిపేరు పెట్టేరు. ఈ పొట్టి పేరుకి ఇంగ్లీషు భాషలోని పెద్దబడిలోని (O) అనే అక్షరాన్నే వాడాలని సర్వులూ ఒప్పుకున్నారు. మనం తెలుగు మీద వీరాభిమానంతో “ఒ” అని రాస్తామంటే పనికి రాదు, అన్ని భాషల వాళ్లూ ఇంగ్లీషు భాష పెద్దబడిలోని “ఒ” (O) రాసి తీరాలి. కనుక తెలుగులో ఆమ్లజని అని కాని, ప్రాణవాయువు అని కాని రాసుకున్నా, హ్రస్వనామం రాసేటప్పుడు మాత్రం O అని ఇంగ్లీషు అక్షరం రాసి తీరాలి.
పూర్వప్రత్యయం సంఖ్య ఉదాహరణ సాంఖ్యక్రమం మోనో 1 కార్బన్ మోనోక్సైడ్ CO డై 2 కార్బన్ డై సల్ఫైడ్ CS2 ట్రై 3 సల్ఫర్ ట్రైఆక్సైడ్ SO3 టెట్ర్ 4 కార్బన్ టెట్రాక్లోరైడ్ CCl4 పెంటా 5 ఫాస్ఫరస్ పెంటాక్సైడ్ PO5 హెక్స్ 6 సల్ఫర్ హెక్సాక్లోరైడ్ SCl6 హెప్ట్ 7 అయొడీన్ హెప్టాప్లోరైడ్ IF7
కార్బన్ మోనాక్సైడ్ అన్నప్పుడు ఒక ఆమ్లజని అణువు ఉందని అర్థం. కార్బన్ డైసల్ఫైడ్ అన్నప్పుడు రెండు గంధకం (సల్ఫర్) అణువులు అని అర్థం సల్ఫర్ ట్రైఆక్సైడ్ అన్నప్పుడు మూడు ఆమ్లజని అణువులు ఉన్నాయని అర్థం చేసుకోవాలి. అయొడీన్ హెప్టాఫ్లోరైడ్ లో ఏడు అయొడీన్ అణువులు ఉన్నాయని గమనించాలి. డైనైట్రొజన్ టెట్రాక్సైడ్ అన్న పదబంధంలో రెండు పూర్వ ప్రత్యయాలు ఉన్నాయి. “డై్” అన్నది రెండు నత్రజని (Nitrogen) అణువులని సూచిస్తోంది, "టెట్రా" అన్నది నాలుగు ఆమ్లజని అణువులని సూచిస్తోంది. కనుక ఈ పదార్థం సాంఖ్యక్రమం N2O4.
రెండు రకాల పూర్వ ప్రత్యయాలు ఉన్నాయి కదా, ఏ ప్రత్యయం ఎప్పుడు వాడాలి అనే సమశ్య ఎదురవటం జరుగుతుంది. మూలకం పేరు హల్లుతో మొదలయితే పూర్వ ప్రత్యయం అచ్చుతో అంతం అయేది వాడాలి: మొనో, టెట్రా-, పెంటా-, హెక్సా-, హెప్టా- అనే పూర్వప్రత్యయాలు వాడాలి. ఉదాహరణ: లెడ్ టెట్రాబ్రోమైడ్ (lead tetrabromide).
రెండు రకాల పూర్వ ప్రత్యయాలు ఉన్నాయి కదా, ఏ ప్రత్యయం ఎప్పుడు వాడాలి అనే సమశ్య ఎదురవటం జరుగుతుంది.
మూలకం పేరు హల్లుతో మొదలయితే పూర్వ ప్రత్యయం అచ్చుతో అంతం అయేది వాడాలి: మొనో, టెట్రా-, పెంటా-, హెక్సా-, హెప్టా- అనే పూర్వప్రత్యయాలు వాడాలి. ఉదాహరణ: లెడ్ టెట్రాబ్రోమైడ్ (lead tetrabromide)
మూలకం పేరు అచ్చుతో మొదలయితే హల్లుతో అంతం అయే పూర్వ ప్రత్యయాలు వాడాలి: మాన్-, డై-, టెట్ర్, పెంట్-, హెక్స్-, హెప్ట్-, వగైరా వాడాలి. ఉదాహరణ: లెడ్ డైఆక్సైడ్ (lead dioxide).
అందరికీ సులభంగా అర్థం కావాలంటే రసాయనాలకి పేర్లు ఒక క్రమ పద్ధతిలో పెట్టాలి. ఈ పద్ధతి కొంచెం క్లిష్టతతో కూడిన వ్యవహారం. అనుభవం మీద నియమాలు అర్థం అవుతాయి. చివర ఇచ్చిన మూలాలు సంప్రదించండి.
ఉదకర్బనాలు (Hydrocarbons)
[మార్చు]రసాయన శాస్త్రంలో ఒక జాతి పదార్థాలు "ఉదకర్బనాలు" (hydrocarbons) అనే పేరుతో చలామణీ అవుతున్నాయి. ఈ ఉదకర్బనపు బణువులలో ఉండే మూలకాలు ముఖ్యంగా రెండు: ఉదజని (hydrogen), కర్బనం (carbon). ఈ రెండింటితోపాటు ఇతర మూలకాలు ఉండొచ్చు; కాని ఈ రెండూ ఉన్నప్పుడు మాత్రమే వాటిని ఉదకర్బనాలు అంటారు.
ఈ ఉదకర్బనాలని రెండు శాఖలుగా విడతీయవచ్చు. మొదటి శాఖని “ఏలిఫేటిక్” (aliphatic) ఉదకర్బనాలు అంటారు. ఇంగ్లీషులో ఫేట్ (fat) అంటే కొవ్వు. ఏలిఫేటిక్ శాఖలో ఉన్నవి కొవ్వులని పోలి ఉంటాయి. వీటి నిర్మాణక్రమం (structural formula) లో సర్వసాధారణంగా కర్బనపు అణువులు బారులు తీర్చి, తిన్నటి గొలుసుల మాదిరి ఉంటాయి. రెండవ శాఖని “ఏరొమేటిక్” (aromatic) ఉదకర్బనాలు అంటారు. ఏరొమేటిక్ అంటే వాసన వేసేవి అని అర్థం. వీటిని, కావాలనుకుంటే, మనం ‘సగంధ ఉదకర్బనాలు’ అని తెలుగులో అనొచ్చు. సగంధ అన్నప్పుడు సుగంధం కావచ్చు, దుర్గంధం కావచ్చు. ఈ సగంధ ఉదకర్బనాల నిర్మాణక్రమంలో సర్వసాధారణంగా చక్రాలు కనిపిస్తూ ఉంటాయి. ‘బారు వడ్డీ, చక్ర వడ్డీ’ అన్నట్లే మొదటి శాఖని ‘బారు ఉదకర్బనాలు’ (straight hydrocarbons) అనిన్నీ రెండవ శాఖని ‘చక్రీయ ఉదకర్బనాలు’ (cyclic hydrocarbons) అనిన్నీ అనొచ్చు. మనకి కావల్సినది ఏమిటంటే పేరుకీ ఆ పేరు వెనక భావానికి అర్థనారీశ్వరులలా అనుబంధం ఉండాలి.
ఆల్కేనులు
[మార్చు]పైన చెప్పిన ఏలిఫేటిక్ శాఖని మూడు కాండాలుగా విభజించవచ్చు. ఈ విభజన కర్బనపు అణువుల మధ్య ఉండే బంధాన్ని బట్టి ఉంటుంది. కర్బనపు అణువుల మధ్య ఏక బంధం మాత్రమే ఉంటే ఆ పదార్థాన్ని “ఆల్కేను” జాతి అంటారు. ఈ ఆల్కేను అనే మాట యొక్క పుట్టు పూర్వోత్తరాలు, ప్రవర మీద పరిశోధన చేసినా ఫలితం ఉండదు. అందుకని తెలుగులో ఈ ఆల్కేను అనే పేరుని వాడెద్దాం. ఇక్కడ గమనార్హమైన విషయం ఏమిటంటే ఈ ఆల్కేన్ అనే ఇంగ్లీషు మాట “ఏన్” (-ane) అనే ప్రత్యయంతో అంతం అవుతుంది. ఇది ఇంటిపేరు లాంటిది. ఈ ప్రత్యయంతో అంతం అయే పదార్థాలన్నీ “ఆల్కేన్ జాతివి” అని జినీవా నిర్ణయం అయిపోయింది. మెతేన్, ఎతేన్, ప్రొపేన్, బ్యుటేన్ (methane, ethane, propane, butane) అన్న పేర్లు చూడండి ఇవన్నీ “ఏన్” (-ane) అనే ప్రత్యయంతో అంతం అవుతున్నాయి కనుక ఇవన్నీ ఆల్కేనులే. వీటన్నిటిలోను ఏకబంధాలే ఉంటాయి.
ఆల్కీనులు
[మార్చు]ఏలిఫేటిక్ శాఖలో రెండవ కాండం పేరు “ఆల్కీనులు” (alkenes). ఈ జాతి పేర్లు అన్నీ “ఈన్” (-ene) శబ్దంతో అంతం అవుతాయి. ఈ ఆల్కీనులన్నిటిలోను, ఒకటి కాని, అంతకంటె ఎక్కువ కాని, జంట బంధాలు (double bonds) ఉంటాయి. కనీసం ఒక్క జంట బంధం ఉండాలన్నా రెండు కర్బనపు అణువులు ఉండి తీరాలి. రెండు కర్బనపు అణువులు, ఒక జంట బంధం ఉన్న పదార్థాలలో అతి సూక్ష్మమైనది ఎతీను (ethene). ఈ శ్రేణిలో తరువాత వచ్చే కొన్ని పదార్థాల పేర్లు: ప్రొపీను (propene), బ్యుటీను (butene).

ఈ ఆల్కీనులని ‘ఓలిఫిన్లు” (olefins) అని కూడా అంటారు. గ్రీకు భాషలో “ఓల్” అంటే చమురు లేదా నూనె అని అర్థం. ఇందులోంచే ఇంగ్లీషు మాట “ఆయిల్” (oil) వచ్చింది. ఒక పదార్థపు నిర్మాణక్రమంలో ఒకటి కంటే ఎక్కువ జంట బంధాలు ఉంటే దానిని “పోలీఓలిఫిన్” (polyolefin) అంటారు. పోలీ అంటే బహు కనుక పోలీఓలిఫిన్ అంటే బహుతైలం. ఈ బహుతైలం పేరు కూడా “ఈన్” (-ene) శబ్దంతోటే అంతం అవాలి. రెండే రెండు జంట బంధాలు ఉన్న బహుతైలం ఉందనుకొండి. ఈ “రెండు”ని సూచించడానికి “డై” అనే పూర్వప్రత్యయం వాడి, దానిని “ఈన్” (-ene) తో సంధిస్తే “డయీన్” (diene) అనే సరికొత్త తోక వస్తుంది కదా. “బ్యూటాడయీన్” అనే రసాయనం ఈ జాతిది. దీనిలో “బ్యూటా” శబ్దం నాలుగు కర్బనపు అణువులు ఉన్నాయని చెబుతోంది. డయీన్ శబ్దం రెండు జంట బంధాలు ఉన్నాయని సూచిస్తోంది. “ఈన్” శబ్దం ఇది ఆల్కీను అని వక్కాణిస్తోంది. ఇప్పుడు 1,3 బ్యూటాడయీన్ నిర్మాణక్రమం రాయడం నల్లేరు మీద బండి నడక. ఈ పక్కనున్న బొమ్మని చూడండి. ఇక్కడ 1,3 అంటే 1 వ, 3 వ కర్బనపు అణువులకి ఉదజని అణువు తగిలించాలి అని అర్థం.
ఆల్కైనులు
[మార్చు]ఏలిఫేటిక్ శాఖ లోని మూడవ కాండం పేరు ఆల్కైనులు (alkynes). ఈ జాతి పేర్లు అన్నీ “ఐన్” (-yne) శబ్దంతో అంతం అవుతాయి. ఈ జాతి పదార్థాల నిర్మాణక్రమంలో ఒకటి కాని, అంతకంటె ఎక్కువ కాని, త్రిపుట బంధాలు ఉండాలి. ఎతైను, ప్రొపైను, బ్యుటైను (ethyne, propyne, butyne) మొదలయినవి ఈ జాతికి చెందుతాయి.
రసాయనాలలో త్రిపుట బంధాలు కంటే ఎక్కువ బంధాలు ఉండడం అసంభవం.
బెంజీను చక్రం
[మార్చు]ఏలిఫేటిక్ (కొవ్వుని పోలిన) పదార్థాల నిర్మాణక్రమంలో కర్బనపు గొలుసులు బారులు తీరి ఉంటే, ఏరొమేటిక్ (సగంధ) పదార్థాలలో కర్బనపు అణువుల అమరికలు ఎక్కువగా చక్రాలతో కూడి ఉంటాయి. ఈ చక్రాల ఆకారాలలో పంచభుజులు, షడ్భుజులు ఎక్కువగా కనిపిస్తాయి. వీటిల్లో షడ్భుజాకారంలో ఉన్న బెంజీను చక్రం చాల కీలకమైనది. ఈ బెంజీను చక్రం నిర్మాణక్రమం రాయాలంటే ముందుగా ఒక షడ్భుజి గీసి, భుజం విడచి భుజం దగ్గర (లేదా ఏకాంతర స్థానాల్లో) జంట బంధం వేసి, ప్రతి మూలని ఒక (-CH) గుంపు తగిలించాలి. అప్పుడు ఆరు కర్బనపు అణువులు, ఆరు ఉదజని అణువులు ఉన్న ఈ బణువుని (C6H6) అని రాస్తారు.
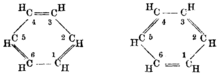

ఏకాంతర స్థానాల్లో జంట బంధాలు వెయ్యాలి అన్నప్పుడు, ఈ జంట బంధాలని రెండు విధాలుగా వెయ్యవచ్చు. ఈ రెండు పదార్థాల లక్షణాల మధ్య ఉన్న తేడాల గురించి చర్చ ఇక్కడ అనవసరం. ఈ బొమ్మని అంతా ఓపికగా గియ్యడానికి బద్ధకించి, అప్పుడప్పుడు దీనిని షడ్భుజిలో సున్న వేసి చూపిస్తారు.
అసలు బెంజీనుకి బెంజీను అన్న పేరు ఎలా వచ్చిందిట? బెంజీను అనే పదార్థం ఆగ్నేయ ఆసియాలో పెరిగే ఒక చెట్టు నుండి కారే బంక. మన తుమ్మబంక లాంటిది అనుకొండి. మనం వాడే సాంబ్రాణి, గుగ్గిలం ఈ జాతి బంక పదార్థాలే. ఈ బంక (జిగురు) ని బెంజమిన్ అనే తెల్ల దొర కనుక్కున్నాడుట. కనుక్కుని తన పేరు పెట్టేసుకున్నాడుట. గుగ్గిలం చెట్టుని బెంజమిన్ దొర కనుక్కోవాలా? బెంజమిన్ కనుక్కున్న పదార్థం కనుక దీనికి బెంజీను అని పేరు పెట్టేసేరు. ఈ పదార్థాన్ని తెలుగులో భైరవాసం అనిన్నీ గొగ్గి అనిన్నీ అంటారుట. ఈ గొగ్గి, గుగ్గిలం జ్ఞాతి పదాలు అయుండవచ్చు. కనుక బెంజీనుని గొగ్గి అనిన్నీ, బెంజీన్ రింగ్ ని గొగ్గి చక్రం అనిన్నీ అంటే తప్పు లేదనుకుంటాను.
ఇలాంటి బెంజీను చక్రాలని రెండింటిని అతికితే నేఫ్తలీను వస్తుంది (బొమ్మ చూడండి), మూడింటిని అతికితే ఏంత్రసీను వస్తుంది.
ఉదకర్బన రాశులు (Hydrocarbon radicals)
[మార్చు]ఏలిఫేటిక్ ఉదకర్బనాల గురించి కొంత వరకు చదివేము కదా. వీటి నిర్మాణక్రమాలని పరిశీలించి ఒక విషయాన్ని గ్రహించవచ్చు. ప్రతి కర్బనపు అణువుకి నాలుగు చేతులు ఉన్నాయి. ఈ నాలుగింటిలో వేటినీ ఖాళీగా ఉంచకుండా, అన్నిటికి ఏదో ఒక అణువుని తగిలించుకుంటూ వస్తున్నాము కదా. ఇప్పుడు ఈ ఏలిఫేటిక్ ఉదకర్బనాల జాతిలో ఒక బణువుని తీసుకుని, దాని నుండి ఒకే ఒక ఉదజని అణువుని తొలగించేమని అనుకుందాం. అలా తొలగించిన తరువాత ఖాళీ చేతితో మిగిలిన బణువుని ఇంగ్లీషులో “రేడికల్” అంటారు. మనం దీనిని తెలుగులో రాశి అందాం. ఇక్కడ రాశి అంటే అణువుల గుంపు అని అర్థం. ఈ సందర్భంలో ఇంగ్లీషు మాట, తెలుగు మాట “ర” అనే శబ్దం తోటే మొదలవుతున్నాయి కనుక రాశిని సూక్ష్మంగా ఇంగ్లీషు అక్షరం “ఆర్” (R) తో సూచించడం ప్రపంచవ్యాప్తంగా ఉన్న పరిపాటి కనుక తెలుగులో కూడా అదే ఆచారాన్ని పాటించవచ్చు.
మెతేను సంగతి మరొకసారి చూద్దాం. ఈ బణువు సాంఖ్యక్రమం (CH4). ఈ బణువు నుండి ఒక ఉదజని అణువుని కత్తిరించి పీకి పారేశాం అని అనుకుందాం. అలా కత్తిరించగా మిగిలినదాని సాంఖ్య క్రమం (-CH3) అని, ముందు ఒక చిన్న గీతతో, రాయడం రివాజు. ఈ (-CH3) ని తెలుగులో మెతల్ రాశి అనిన్నీ, ఇంగ్లీషులో మెతల్ రేడికల్ అనిన్నీ అంటారు. ఇక్కడ (-CH3) లో ముందు ఉన్న చిన్న గీత ఖాళీ చేతిని సూచిస్తుంది. ఖాళీ చేతులు ఉన్న రాశి చాల చురుగ్గా ఉంటుంది.
మెతేను నుండి మెతైల్ రాశి (-CH3) వచ్చినట్లే ఎతేను నుండి ఎతైల్ రాశి (-C2H5), ప్రొపేను నుండి ప్రొపైల్ రాశి (-C3H7), బ్యుటేన్ నుండి బ్యుటైల్ రాశి (-C4H9), పెంటేన్ నుండి ఎమైల్ రాశి (-C5H11) (పెంటైల్ అనేది కొత్త పేరు, ఎమైల్ ప్రాచుర్యంలో ఉన్న పాత పేరు), అనుకుంటూ వెళ్లవచ్చు.
ఫంక్షనల్ గుంపులు
[మార్చు]రాశికి ఒక రిక్త హస్తం ఉంటుంది. ఈ ఖాళీ చేతికి మనకి ఏది తోస్తే దానిని తగిలించవచ్చు; ఏకాకిగా ఉన్న ఒక అణువుని తగిలించవచ్చు, లేదా ఎన్నో అణువులు ఉన్న అణుసమూహాన్ని తగిలించవచ్చు. ఏదో పైలా పచ్చీసుగా కాకుండా, ఒక క్రమ పద్ధతిలో, ఈ ఖాళీ చేతికి రకరకాల అణుసముదాయాలని తగిలించి రకరకాల రసాయనాలని తయారు చెయ్యవచ్చు. ఇలా రాసుల రిక్త హస్తాలకి తగిలించే అణు సమూహాలని ఇంగ్లీషులో “ఫంక్షనల్ గ్రూప్స్” (functional groups) అంటారు. ఈ పద్ధతిలో సౌకర్యం ఏమిటో చూద్దాం.
ఆల్కహాలు జాతి: సాధారణ సాంఖ్యక్రమం (ROH)
[మార్చు]ఒక ఉదకర్బన రాశి (R) ని తీసుకుని దానికి (–OH) గుంపు (కార్బాక్సిల్ గుంపు) తగిలిస్తే ఆల్కహాలు వస్తుంది. కనుక ఆల్కహాలు జాతిని అంతటినీ ROH అని క్లుప్తంగా సూచించవచ్చు. ఇందులో (R) మెతల్ రాశి అయితే ఆ పదార్థం మెతల్ ఆల్కహాలు (లేదా, మెతనోలు). ఇక్కడ (R) ఎతల్ రాశి అయితే ఈ పదార్థం ఎతల్ ఆల్కహాలు (లేదా, ఎతనోలు). తేలిగ్గా లేదూ?
ఆల్డిహైడులు: సాధారణ సాంఖ్యక్రమం (RCOH)
[మార్చు]ఒక ఉదకర్బన రాశి (R) ని తీసుకుని దానికి (–COH) గుంపు (కార్బనిల్ గుంపు) ని తగిలిస్తే మనకి ఆల్డిహైడ్ వస్తుంది. కనుక ఆల్డిహైడ్ జాతిని అంతటినీ (RCOH) అని క్లుప్తంగా సూచించవచ్చు. ఇందులో (R) మెతల్ రాశి అయితే ఆ పదార్థం మెతల్ ఆల్డిహైడ్ (లేదా, మెతనాలు). ఇక్కడ (R) ఎతల్ రాశి అయితే ఈ పదార్థం ఎతల్ ఆల్డిహైడ్ (లేదా, ఎతనాలు). ఇక్కడ ఇంగ్లీషు వర్ణక్రమం, ఉచ్చారణ గమనించండి. మెతనాలుకీ మెతనోలుకీ మధ్య తేడా ఉంది. అలాగే ఎతనాలుకీ ఎతనోలుకీ మధ్య తేడా ఉంది.
ఈథరులు: సాధారణ సాంఖ్యక్రమం (ROR)
[మార్చు]రెండు ఉదకర్బన రాశులు తీసుకుని వాటి మధ్య ఒక ఆమ్లజని (O) ని ఇరికిస్తే ఈథర్ జాతి పదార్థాలు వస్తాయి. రాశి-ఆమ్లజని-రాశి (ROR) ఆ వరసలో రావాలి. కనుక అందాకా వీటిని “రా-ఆ-రా” అని కాని, టూకీగా “రారా” అని కాని అందాం. ఈ రారాలో ఆమ్లజనికి ఇరుపక్కలా ఒకే రకం రాశి ఉండాలని నియమం ఏదీ లేదు. కాని రెండు రాశులూ ఎతల్ రాశులు అయిన పక్షంలో మనకి “డైఎతల్ఈథర్” (diethylether) వస్తుంది. ఇది తెలుగులో ద్వివిధైల్రారా అవుతుంది.
కీటోనులు: సాధారణ సాంఖ్యక్రమం (RCOR)
[మార్చు]
ఈథరులకి మల్లే కీటోనులకి కూడా రెండు ఉదకర్బన రాశులు ఇటూ, అటూ వందిమాగదుల్లా ఉంటాయి. వీటి మధ్య ఒక కార్బనిల్ (CO) ని ఇరికిస్తే కీటోను జాతి పదార్థాలు వస్తాయి. రాశి-కార్బనిల్-రాశి (RCOR) ఆ వరసలో రావాలి. కనుక వీటిని “రా-క-రా” అని అందాం. ఈ రాకరాల్లో కార్బనిల్కి ఇరుపక్కలా ఒకే రకం రాశి ఉండాలని నియమం ఏదీ లేదు. కాని రెండు రాశులూ మెతల్ రాశులు అయిన పక్షంలో మనకి “డైమెతల్కీటోన్” (dimethylketone) వస్తుంది. ఇది తెలుగులో ద్విపాడైల్రాకరా అవుతుంది. ఈ రాకరాకి వాడుకలో ఉన్న ఇంగ్లీషు పేరు ఎసిటోను (acetone). బొమ్మ చూడండి.
ఆమ్లములు: సాధారణ సాంఖ్యక్రమం (RCOOH)
[మార్చు]కార్బాక్సిల్ గుంపు (COOH) ఉన్న పదార్థాలన్నీ ఆమ్లములు. ఇక్కడ (RCOOH) లో (R) మెతేన్ అయితే ఇది మెతనోయిక్ ఆమ్లం (methanoic acid) అవుతుంది. దీని సాధారణ నామం ఫార్మిక్ ఏసిడ్ (formic acid). దీనినే తెలుగులో పిపీలికామ్లం అంటారు. పిపీలికం అంటే చీమ.
అదే విధంగా (RCOOH) లో (R) ఎతేన్ అయితే అది ఎతనోయిక్ ఆమ్లం (ethanoic acid). దీని సాధారణ నామం ఎసిటిక్ ఏసిడ్. ఆఖరుగా, (RCOOH) లో (R) అష్టాదశేన్ (ఆక్టాడెకేన్, octadecane) అయినప్పుడు మనకి అష్టాదశోయిక్ ఆమ్లం (ఆక్టాడెకనోయిక్ ఏసిడ్, Octadecanoic acid) వస్తుంది. దీనినే స్టీరిక్ ఏసిడ్ (stearic acid) అని కూడా అంటారు.
ఆమ్లాలన్నిటిలోను ఒకే ఒక కార్బాక్సిల్ గుంపు ఉండాలని నియమం ఏదీ లేదు. ఉదాహరణకి ఎతేన్ బణువులో రెండు కార్బాక్సిల్ గుంపులు ప్రవేశపెడితే ఆక్సాలిక్ ఆమ్లం (oxalic acid) వస్తుంది. ఇదే విధంగా మెతేను బణువులో మూడు కార్బాక్సిల్ గుంపులు ప్రవేశపెడితే సిట్రిక్ ఏసిడ్ (citric acid) వస్తుంది. నిమ్మ, నారింజ, వగైరాలకి పులుపునిచ్చేది ఈ సిట్రిక్ ఆమ్లమే.
మూలాలు
[మార్చు]- వేమూరి వేంకటేశ్వరరావు, నిత్యజీవితంలో రసాయన శాస్త్రం, ఇ-పుస్తకం, కినిగె ప్రచురణ, kinige.com
- https://web.archive.org/web/20150815064201/http://www.emsb.qc.ca/laurenhill/science/name.html
- How to name chemical compounds, http://www.wikihow.com/Name-Chemical-Compounds
