క్లోరిన్ డయాక్సైడ్
| |||

| |||
| పేర్లు | |||
|---|---|---|---|
| IUPAC నామము
Chlorine dioxide
| |||
| ఇతర పేర్లు
Chlorine(IV) oxide
| |||
| గుర్తింపు విషయాలు | |||
| సి.ఎ.ఎస్. సంఖ్య | [10049-04-4] | ||
| పబ్ కెమ్ | 24870 | ||
| యూరోపియన్ కమిషన్ సంఖ్య | 233-162-8 | ||
| వైద్య విషయ శీర్షిక | Chlorine+dioxide | ||
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:29415 | ||
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | FO3000000 | ||
| SMILES | O=[Cl]=O | ||
| |||
| జి.మెలిన్ సూచిక | 1265 | ||
| ధర్మములు | |||
| ClO2 | |||
| మోలార్ ద్రవ్యరాశి | 67.45 g·mol−1 | ||
| స్వరూపం | Yellow to reddish gas | ||
| వాసన | Acrid | ||
| సాంద్రత | 2.757 g dm−3 | ||
| ద్రవీభవన స్థానం | −59 °C (−74 °F; 214 K) | ||
| బాష్పీభవన స్థానం | 11 °C (52 °F; 284 K) | ||
| 8 g dm−3 (at 20 °C) | |||
| ద్రావణీయత | soluble in alkaline and sulfuric acid solutions | ||
| బాష్ప పీడనం | >1 atm< | ||
| kH | 4.01 x 10−2 atm-cu m/mole | ||
| ఆమ్లత్వం (pKa) | 3.0(5) | ||
| ఉష్ణగతిక రసాయన శాస్త్రము | |||
| నిర్మాణము మారుటకు కావాల్సిన ప్రామాణిక ఎంథ్రఫీ ΔfH |
104.60 kJ/mol | ||
| ప్రామాణిక మోలార్ ఇంథ్రఫీ S |
257.22 J K−1 mol−1 | ||
| ప్రమాదాలు | |||
| భద్రత సమాచార పత్రము | ICSC 0127 | ||
| ఇ.యు.వర్గీకరణ | {{{value}}} | ||
| R-పదబంధాలు | మూస:R6, R8, R26, R34, R50 | ||
| S-పదబంధాలు | (S1/2), మూస:S23, S26, S28, S36/37/39, S38, S45, S61 | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose)
|
292 mg/kg (oral, rat) | ||
LCLo (lowest published)
|
260 ppm (rat, 2 hr)[2] | ||
| US health exposure limits (NIOSH): | |||
PEL (Permissible)
|
TWA 0.1 ppm (0.3 mg/m3) | ||
REL (Recommended)
|
TWA 0.1 ppm (0.3 mg/m3) ST 0.3 ppm (0.9 mg/m3)[1] | ||
IDLH (Immediate danger)
|
5 ppm[1] | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox references | |||
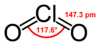
క్లోరిన్ డయాక్సైడ్ ఒకరసాయన సంయోగ పదార్థం. ఇది అకర్బన సంయోగ పదార్థం. క్లోరిన్, ఆక్సిజన్ పరమాణు సంయోగం వలన ఏర్పడిన సమ్మేళన పదార్థం. క్లోరిన్ డయాక్సైడ్ యొక్క రసాయనిక ఫార్ములా ClO2.పసుపు/పచ్చని ఈ వాయువు −59 °C వద్ద ప్రకాశవంతమైన ఆరెంజి స్పటికాలుగా ఏర్పడును. ఇది బలమైన ఆక్సీకరణ కారకం, విరంజన పదార్థం.
సౌష్టవం , బంధం
[మార్చు]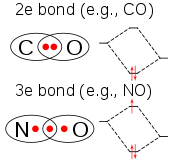

క్లోరిన్ డయాక్సైడ్ ఒక తటస్థ రసాయన సమ్మేళనం. క్లోరిన్ డయాక్సైడ్ రసాయన సమ్మేళనం ఆది మూలమైన క్లోరిన్ కన్న రసాయన నిర్మాణం లోను, ప్రవర్తనలో భిన్నమైనది.క్లోరిన్ డయాక్సైడ్ నీటిలో అధిక ద్రావణీయత, అదియును కూడా చల్లని నీటిలో అధికంగా కల్గిఉన్నది.నీటితో క్లోరిన్ డయాక్సైడ్ కలిసినపుడు, ఈ రసాయన సంయోగ పదార్థం జలవిశ్లేషణ చెందక, నీటిలోఅందులో కరిగిన వాయు స్థితిలో ఉండును.క్లోరిన్ వాయువు నీటిద్రావణీయత కన్న, క్లోరిన్ డయాక్సైడ్ నీటిలో ద్రావణీయత పదిరెట్లు ఎక్కువ.క్లోరిన్ డయాక్సైడ్ అణువు భేసి సంఖ్యలో సంయోగ సామర్ధ్య ఎలక్ట్రాన్ లను కలిగిఉన్నందున ఇది ఒక పారా మెగ్నటిక్ రాడికల్ (paramagnetic radical).
భౌతిక ధర్మాలు
[మార్చు]క్లోరిన్ డయాక్సైడ్ పసుపు వర్ణపు వాయువు.కొన్ని సార్లు ఎరుపు రంగులో కూడా ఉండును.క్లోరిన్ డయాక్సైడ్ వాయువు ఘాటైన వాసన కల్గి ఉంది.క్లోరిన్ డయాక్సైడ్ యొక్క అణుభారం 67.45 గ్రాము లు/మోల్−1[3].సాథారణ ఉష్ణోగ్రత స్థితివద్ద ( 25 °C) క్లోరిన్ డయాక్సైడ్ సాంద్రత 2.757 గ్రాములు/dm−3 (1.64ద్రాములు/మి.లీ, ద్రవస్థితి).[4] క్లోరిన్ డయాక్సైడ్ వాయువు ద్రవీభవన స్థానం −59 °C (−74 °F; 214 K). క్లోరిన్ డయాక్సైడ్ వాయువు బాష్పీభవన స్థానం 11 °C (52 °F; 284K).నీటిలో క్లోరిన్ డయాక్సైడ్ వాయువు కరుగును. నీటిలో ద్రావణీయత 8 g dm−3 (20°Cవద్ద).క్షారయుత ద్రావణాలలో, సల్ఫ్యూరిక్ ఆమ్లంలో కరుగును. క్లోరిన్ డయాక్సైడ్ వాయువు బాష్పవత్తిడి >1 atm.
ఆవిష్కరణ
[మార్చు]సా.శ.1814 లో మొదటిగా సర్ హంప్రి డెవి క్లోరిన్ డయాక్సైడ్ వాయువునును కనుగొన్నాడు.సల్ఫ్యూరిక్ ఆమ్లాన్ని పొటాషియం క్లోరేట్ (KClO3) పై ఫోసి క్లోరిన్ డయాక్సైడ్ వాయువును, తరువాత హైపోక్లోరస్ ఆమ్లం (HOCl) ద్వారా సల్ఫ్యూరిక్ ఆమ్లాన్ని తొలగించాడు.[5] 1944 లో మొదటగా క్లోరిన్ డయాక్సైడ్ను త్రాగునీటి క్రిమి సంహరిణీగా, రుచి, వాసన నియంత్రిణిగా అమెరికాలోని నయాగార జలపాతంలో ఉపయోగించారు.[6]
ఉత్పత్తి
[మార్చు]ప్రయోగ శాలలో ఉత్పత్తి కావించడం
[మార్చు]ప్రయోగ శాలల్లో సోడియం క్లోరేట్ను ఆక్సీకరించడం ద్వారా క్లోరిన్ డయాక్సైడ్ ను ఉత్పత్తి చేయుదురు.
- NaClO2 + ½ Cl2 → ClO2 + NaCl
అలాగే పొటాషియం క్లోరేట్ ను ఆక్సాలిక్ ఆమ్లంతో రసాయన చర్య జరిపించడం వలన కూడా క్లోరిన్ డయాక్సైడ్ ను ఉత్పత్తి చేయుదురు.
- KClO3 + H2C2O4 → ½ K2C2O4 + ClO2 + CO2 + H2O
- KClO3 + ½ H2C2O4 + H2SO4 → KHSO4 + ClO2 + CO2 + H2O
పారిశ్రామిక స్థాయిలో ఉత్పత్తి
[మార్చు]ప్రపంచవ్యాప్తంగా ఉత్పత్తి అవుచున్న క్లోరిన్ డయాక్సైడ్ లో 95%ను కాగితపు పరిశ్రమల కండ/గిజురు/గుజ్జు (pulp) ను విరజనంచేయుటకు వాడుచున్నారు.కాగితపు పరిశ్రమలలో ఉపయోగించు క్లోరిన్ డయాక్సైడ్ ను సోడియం క్లోరేట్ నుండి ఉత్పత్తి చేస్తున్నారు.
సోడియం క్లోరేట్ ను బలమైన ఆమ్ల ద్రావణంలో మిథనాల్, హైడ్రోజన్ పెరాక్సైడ్.హైడ్రోక్లోరిక్ ఆమ్లం లేదా సల్ఫర్ డయాక్సైడ్ వంటి తగిన క్షయికరనకారకంతో క్షయికరిచడ ద్వారా క్లోరిన్ డయాక్సైడ్ ఉత్పత్తి చేయుదురు.నేడు ఆధునిక సాంకేతిక ఉత్పత్తి పద్ధతులల్లో మిథనాల్ లేదా హైడ్రోజన్ పెరాక్సైడ్ లను ఉపయోగిస్తున్నారు. వీటి వినియోగం ఆర్థికంగా ప్రయోజన కరం,, మూలక క్లోరిన్ ఉపఉత్పత్తిగా ఏర్పడదు.మొత్తం రసాయన ప్రక్రియను ఈ దిగువ విధంగా వ్రాయవచ్చును.
- క్లోరేట్+ఆమ్లం+క్షయికరణకారకం→ క్లోరిన్ డయాక్సైడ్ +ఉప ఉత్పత్తులు
రియాక్టరులో (రసాయన చర్య జరుగు ఉపకరణ౦) సోడియం క్లోరేట్, హైడ్రోక్లోరిక్ ఆమ్లం లమధ్య రసాయనిక ప్రతి క్రియ ఈ దిగువ సూచించిన క్రమంలో జరుగునని విశ్వసిస్తారు.
- ClO−3 + Cl− + H+ → ClO−2 + HOCl
- ClO−3 + ClO−2 + 2H+ → 2ClO2 + H2O
- HOCl + Cl− + H+ → Cl2 + H2O
పై రసాయనచర్యలను ప్రక్రియలను క్రింది విధంగా సమీకరణం చేయవచ్చును.
- 2ClO−3 + 2Cl− + 4H+ → 2ClO2 + Cl2 + 2H2O .
ఇతర ఉత్పత్తి విధానాలు
[మార్చు]సంప్రాదాయకంగా రోగక్రిమినాశనిగా ఉపయోగించు క్లోరిన్ డయాక్సైడ్ ను మూడు పద్ధతులలోఎదో ఒక ప్రక్రియ విధానంలో సోడియం క్లోరైట్ ఉపయోగించి లేదా సోడియం క్లోరైట్-హైపోక్లోరేట్ ను ఉపయోగించి తయారు చేసెదరు.
- 2 NaClO2 + 2 HCl + NaOCl → 2 ClO2 + 3 NaCl + H2O
లేదా సోడియం క్లోరైట్-హైపోక్లోరేట్ విధానం:
- 5 NaClO2 + 4 HCl → 5 NaCl + 4 ClO2 + 2 H2O
అతి శుద్ధమైన క్లోరిన్ డయాక్సైడ్ ను క్లోరైట్ ద్రావణాన్ని విద్యుద్విశ్లేషణ కావించడం వలన ఉత్పత్తి చేయుదురు.
- 2 NaClO2 + 2 H2O → 2 ClO2 + 2 NaOH + H2
ఉత్తమస్థాయి శుద్ధ క్లోరిన్ డయాక్సైడ్ వాయువును వాయువు-ఘన విధానంలో ఉత్పత్తి కావించెదరు.ఈ విధానంలో సజల (dilute) (తక్కువ గాఢత) క్లోరిన్ వాయువు ఘన సోడియం క్లోరేట్ తో చర్య వలన ఏర్పడును.
- 2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
రసాయన చర్యాశీలత
[మార్చు]వాయు స్థితిలో ప్రామాణిక /స్థిర ఉష్ణోగ్రత, వత్తిడి వద్ద (STP ) (మరింత నిక్కచ్చిగా చెప్పాలంటే 10 kPa వత్తిడివద్ద) గాలిలో క్లోరిన్ డయాక్సైడ్ 30% మించి ఏర్పడిన/ఉన్నక్లోరిన్ డయాక్సైడ్ విస్పోటకంగా (explosively) క్లోరిన్, ఆక్సిజన్గా వియోగం/విఘటన చెందును.ఈ విస్పోటక ఉభయ వియోగం కాంతి వలన, వేడి ఉత్పాదికాలవలన (hot spots, రసాయనచర్య వలన లేదా ఆకస్మిక వత్తిడి ఘాతకం (pressure shock) వలన జరుగ వచ్చును[6].
అందువలన అధిక గాఢత కల్గిన క్లోరిన్ డయాక్సైడ్ ను ఉపయోగించరాదు. ఎల్లపుడు నీటిలో 0.5 నుండి 10 గ్రాములు లీటరు నీటిలో కరిగించిన క్లోరిన్ డయాక్సైడ్ ను మాత్రమే వాడాలి.తక్కువ ఉష్ణోగ్రతలో క్లోరిన్ డయాక్సైడ్ ద్రావణీయత పెరుగుతుంది. అందువలన లీటరు నీటిలో 5 గ్రాములకుమించి క్లోరిన్ డయాక్సైడ్ నిల్వ ఉంచవలసిన క్లోరిన్ డయాక్సైడ్ ను శీతలనీటిలో (5 °C, లేదా41 °F) కరగించుట సాధారణం.అమెరికా దేశంలో ఎటువంటి గాఢతలోనైనను రవాణాకు అనుమతించరు.ఉపయోగించు ప్రాంతంలోనే క్లోరిన్ డయాక్సైడ్ ను ఉత్పత్తి చేయవలెను.
ఉపయోగాలు
[మార్చు]క్లోరిన్ డయాక్సైడ్ ను కలప గుజ్జును విరంజనం చేయుటకు, నగర పాలిక సంస్థల నీటిశుద్ధీకరణ వ్యవస్థలో క్రిమిసంహరనిగా (ఈఈ ప్రక్రియను క్లోరినేసన్ అంటారు). క్లోరిన్ డయాక్సైడ్ క్రియాశీల తత్త్వం వలన అతితక్కువ గాఢతలో కుడా ఇది క్రిమినాశినిగా ప్రభావ వంతంగా పనిచేయును.
క్రిమిసంహారకం, రోగక్రిమినాశని
[మార్చు]క్లోరిన్ డయాక్సైడ్ ను కొద్ది మొత్తంలో క్రిమిసంహారకం, రోగక్రిమినాశనిగా కూడా ఉపయోగిస్తున్నారు[5].19 శతాబ్ది నుండి క్రమంగా క్లోరిన్ డయాక్సైడ్ ను నిటిశుద్ధికరణ ప్రక్రియలలో, లఘు స్థితి/స్థాయిలో ఇతరత్రా వాడకానికి క్లోరిన్ డయాక్సైడ్ ను క్లోరేట్, హైడ్రోజన్ పెరాక్సైడ్,, సల్ఫ్యూరిక్ ఆమ్లాలను ఉపయోగించి తయారు చేసేవారు.ఈ విధానంలో ఇది క్లోరిన్ రహిత ఉత్పదాకం, అధిక సామర్ధ్యంతో ఉత్పత్తి చేసేవారు.
కొన్నిసార్లు క్లోరిన్ డయాక్సైడ్ ను త్వరితంగా, సులభంగా బూజు, ఈస్ట్ వంటి వాటి దాడికి లోనగు బ్లూబెర్రీ, రాస్బెర్రీ, స్ట్రాబెర్రీ వంటి పళ్ళను శానిటైస్ చేయుటకు ధూమకారి (fumigant) గా ఉపయోగిస్తారు.
నల్లుల (bedbug) నివారణలో కూడా క్లోరిన్ డయాక్సైడ్ ను ఉపయోగిస్తారు. కొన్నిరకాల శంబుక (mussels) లను నాశనం చేయుటకు వాడెదరు.
విరంజన రసాయనంగా
[మార్చు]కొన్ని సందర్భాలలో క్లోరిన్ డయాక్సైడ్ ను క్లోరిన్ వాయుతో కలిపి కలపగుజ్జును విరంజనం చేయుటకు వాడినాను, ఎక్కువగా ECF (elemental chlorine-free) విరంజన ప్రక్రియలలో క్లోరిన్ డయాక్సైడ్ ను విరంజనకారిగా వాడెదరు.క్లోరిన్ డయాక్సైడ్ ను విరంజనకారిగా మితముగా pH (3.5 నుండి 6) ( ఆమ్లగుణం) ఉండేలా ఉపయోగిస్తారు.. క్లోరిన్ డయాక్సైడ్ ను విరంజనకారిగా వాడటం వలన ఆర్గానోక్లోరిన్ సమ్మేళన పదార్థాలు ఏర్పడటం తగ్గును. ప్రపంచ వ్యాప్తంగా క్లోరిన్ డయాక్సైడ్ ను (ECF technology) విరంజనకారిగా ఉపయోగిస్తున్నారు.
పిండిని విరంజనం చేయుటకు కూడా క్లోరిన్ డయాక్సైడ్ ను విరంజనకారిగా ఉపయోగిస్తారు.
ఇతర ఉపయోగాలు
[మార్చు]వ్యర్థ నీటి ప్రవాహము లోని ఫినోల్ ను నాశనం చేయుటకు క్లోరిన్ డయాక్సైడ్ ను ఆక్సికరణిగా ఉపయోగిస్తారు.జంతు ఉప ఉత్పత్తులపరిశ్రమలలోని ఎయిర్ స్క్రబ్బర్స్ (air scrubbers) లోని దుర్గంధాన్నితొలగించుటకు క్లోరిన్ డయాక్సైడ్ ను ఉపయోగిస్తారు.
క్లోరిన్ డయాక్సైడ్- ముందస్తు రక్షణ జాగ్రత్తలు
[మార్చు]క్లోరిన్ డయాక్సైడ్ విశాకారి, అందువలన తగుజాగ్రత్తలు తీసుకోవాలి. యునైటెడ్ స్టేట్స్ ఎన్విరోన్ మెంట్ ప్రొ ఏజెన్సిటెక్షన్ (సంయుక్త రాష్ట్రాల పరిసరాల పరిరక్షణ సంస్థ, నిర్ణయించినప్రకారం, మంచి నీటిలో క్లోరిన్ డయాక్సైడ్ గరిష్ఠ ప్రమాణం౦.8మీ.గ్రాంలు/లీటరుకు మించరాదు.
మూలాలు/ఆధారాలు
[మార్చు]- ↑ 1.0 1.1 ఉల్లేఖన లోపం: చెల్లని
<ref>ట్యాగు;PGCHఅనే పేరుగల ref లలో పాఠ్యమేమీ ఇవ్వలేదు - ↑ ఉల్లేఖన లోపం: చెల్లని
<ref>ట్యాగు;IDLHఅనే పేరుగల ref లలో పాఠ్యమేమీ ఇవ్వలేదు - ↑ "CHLORINE DIOXIDE". pubchem.ncbi.nlm.nih.gov. Retrieved 2016-03-23.
- ↑ "CHLORINE DIOXIDE AND CHLORITE" (PDF). atsdr.cdc.gov. Retrieved 2016-03-23.
- ↑ 5.0 5.1 "Disinfectants Chlorine Dioxide". lenntech.com. Retrieved 2016-03-22.
- ↑ 6.0 6.1 "CHLORINE DIOXIDE". cdautism.org. Archived from the original on 2016-03-23. Retrieved 2016-03-23.