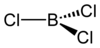
బోరాన్ ట్రైక్లోరైడ్
| |||
| పేర్లు | |||
|---|---|---|---|
| IUPAC నామము
బోరాన్ ట్రై క్లోరైడ్
| |||
| ఇతర పేర్లు
బోరాన్(III) క్లోరైడ్
ట్రై క్లోరో బోరేన్ | |||
| గుర్తింపు విషయాలు | |||
| సి.ఎ.ఎస్. సంఖ్య | [10294-34-5] | ||
| పబ్ కెమ్ | 25135 | ||
| యూరోపియన్ కమిషన్ సంఖ్య | 233-658-4 | ||
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | ED1925000 | ||
| SMILES | [BH6+3].[Cl-].[Cl-].[Cl-] | ||
| |||
| ధర్మములు | |||
| BCl3 | |||
| మోలార్ ద్రవ్యరాశి | 117.17 g/mol | ||
| స్వరూపం | Colorless gas, fumes in air | ||
| సాంద్రత | 1.326 g/cm3 | ||
| ద్రవీభవన స్థానం | −107.3 °C (−161.1 °F; 165.8 K) | ||
| బాష్పీభవన స్థానం | 12.6 °C (54.7 °F; 285.8 K) | ||
| decomposes | |||
| ద్రావణీయత | soluble in CCl4, ethanol | ||
| అయస్కాంత ససెప్టిబిలిటి | -59.9·10−6 cm3/mol | ||
| వక్రీభవన గుణకం (nD) | 1.00139 | ||
| నిర్మాణం | |||
| Trigonal planar (D3h) | |||
ద్విధృవ చలనం
|
zero | ||
| ఉష్ణగతిక రసాయన శాస్త్రము | |||
| నిర్మాణము మారుటకు కావాల్సిన ప్రామాణిక ఎంథ్రఫీ ΔfH |
-427 kJ/mol | ||
| ప్రామాణిక మోలార్ ఇంథ్రఫీ S |
206 J/mol K | ||
| విశిష్టోష్ణ సామర్థ్యం, C | 107 J/mol K | ||
| ప్రమాదాలు | |||
| ప్రధానమైన ప్రమాదాలు | May be fatal if swallowed or if inhaled Causes serious burns to eyes, skin, mouth, lungs, etc. Contact with water gives HCl | ||
| భద్రత సమాచార పత్రము | ICSC | ||
| జి.హెచ్.ఎస్.పటచిత్రాలు |   
| ||
| జి.హెచ్.ఎస్.సంకేత పదం | DANGER | ||
| జి.హెచ్.ఎస్.ప్రమాద ప్రకటనలు | H330, H300, H314 | ||
| ఇ.యు.వర్గీకరణ | {{{value}}} | ||
| R-పదబంధాలు | R14, R26/28, R34 | ||
| S-పదబంధాలు | (S1/2), S9, S26, S28, S36/37/39, S45 | ||
| జ్వలన స్థానం | {{{value}}} | ||
| సంబంధిత సమ్మేళనాలు | |||
| ఇతరఅయాన్లు | {{{value}}} | ||
ఇతర కాటయాన్లు
|
Aluminium chloride Gallium chloride | ||
సంబంధిత సమ్మేళనాలు
|
Boron trioxide Carbon tetrachloride | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox references | |||
బోరాన్ ట్రైక్లోరైడ్ఒక అకర్బన రసాయన సంయోగ పదార్ధం.బోరాన్, క్లోరిన్ మూలకాల పరమాణువుల సంయోగం వలన ఈ రసాయన సమ్మేళనపదార్ధం ఏర్పడినది.ఈ రసాయన పదార్ధం యొక్క రసాయన ప్రాథమిక సాధారణ ఫార్ములా . బోరాన్ ట్రైక్లోరైడ్ వర్ణరహిత వాయుపదార్ధం. సేంద్రియ సంశ్లేషణలో బోరాన్ ట్రైక్లోరైడ్ ఎంతో ప్రాముఖ్యమున సమ్మేళన పదార్ధం. నీటితో అత్యంత చర్యావంతంగా వుండును.
ఉత్పత్తి
[మార్చు]బోరాన్ మూలకం హలోజేన్స్(ఫ్లోరిన్, క్లోరిన్,బ్రోమిన్,అయోడిన్), అస్టటైన్)తో రసాయనచర్య జరిపి ట్రైహైలైడ్స్ ఏర్పరచును.అయినప్పటికీ 500°C ఉష్ణోగ్రత వద్ద బోరాన్ ఆక్సైడ్, కార్బన్ ను క్లోరినేసన్ చేసి బోరాను ట్రైక్లోరైడును ఉత్పత్తి చేయుదురు.
- B2O3 + 3C + 3 Cl2 → 2 BCl3 + 3 CO
ఈ కార్బో థేర్మిక్ ప్రక్రియ చర్య, టైటానియం డైఆక్సైడ్ ను టైటానియం టెట్రాక్లోరైడ్ గా పరివర్తించు క్రోల్ ప్రక్రియ(Kroll process )కు తుల్యమైనది. ప్రయోగశాలల్లో అల్యూమినియం ట్రైక్రోరైడ్(AlCl3 ) తో ఫ్లోరోబోరాన్(BF3)చర్యలో హాలోజన్ పరస్పరమార్పిడి చర్యవలన బోరాన్ ట్రైక్లోరైడు ఏర్పడును.
అణు సౌష్టవం
[మార్చు]బోరాన్ ట్రై క్లోరైడ్ అణుసౌష్టవం మిగతా ట్రైహలైడుల వలే త్రిభుజాకృత మైన సమతల అణునిర్మాణం పొంది వున్నది. బంధదూరం175pm.
భౌతిక లక్షణాలు
[మార్చు]భౌతిక స్థితి-రూపం
[మార్చు]ఇది రంగులేని వాయువు.గాలి లో కలిసినపుడు తెల్లని పొగలను వెలువరించును.
అణుభారం
[మార్చు]బోరాన్ ట్రైక్లోరైడ్ అణుభారం 117.17గ్రాములు/మోల్[1]
సాంద్రత
[మార్చు]సాధారణ ఉష్ణోగ్రత] దగ్గర బోరాన్ ట్రై క్లోరైడ్సాంద్రత 1.326 గ్రాములు/సెం.మీ3.లేదా 0.3141 పౌండ్లు/ఘనపు అడుగు[2]
ద్రవీభవన ఉష్ణోగ్రత
[మార్చు]బోరాన్ ట్రైక్లోరైడ్ ద్రవీభవన స్థానం: −107.3°C(−161.1°F; 165.8K)[3]
బాష్పీభవన ఉష్ణోగ్రత
[మార్చు]బోరాన్ ట్రైక్లోరైడ్ బాష్పీభవన స్థానం: 12.6°C (54.7°F; 285.8K)[3]
ద్రావణీయత
[మార్చు]నీటితో చర్య వలన విఘటన చెందును. కార్బన్ టెట్రాక్లోరైడ్, ఇథనాల్ లో కరుగును
రసాయన చర్యలు
[మార్చు]బోరాన్ ట్రైక్లోరైడ్ నీటితో జలవిశ్లేషణ చర్య వలన హైడ్రోక్లోరిక్ ఆమ్లం, బోరిక్ ఆమ్లాన్ని ఏర్పరచును.
ఆల్కహాలుల జలవిష్లేనణకు తుల్యమైనచర్య వలన బోరేట్ ఈస్టరులుఏర్పడును. ఉదా హరణకు ట్రైమిథైల్ బోరేట్.బోరాన్ ట్రై క్లోరైడ్ బలమైన లేవిస్ ఆమ్లంగా టెరిటియరి అమైనులు, ఫాస్పైన్సులు. ఈథర్సు, థయోఈథర్సు, హైలైడ్ అయానులతో సంక్లిష్ట పదార్థాలను(adducts)ఏర్పరచును.
క్షయికరణ
[మార్చు]బోరాన్ ట్రైక్లోరైడ్ ను క్షయికరణవలన మూలక బోరాన్ ఉత్పత్తిని వ్యాపారస్థాయిలోచేస్తారు.ప్రయోగ/పరిశోధనశాలల్లో బోరాన్ ట్రైక్లోరైడ్ ను రాగి లోహంతో వేడి చెయ్యడం వలన డైబోరాన్ టెట్రాక్లోరైడ్ ఉత్పత్తి అగును.
ఉపయోగాలు
[మార్చు]మూలకబోరాన్ ఉత్పత్తికి బోరాన్ ట్రైక్లోరైడ్ ప్రారంభ రసాయన పదార్ధంగా పనిచేయును. బోరాన్ ట్రైక్లోరైడ్ ను అల్యూమినియం, మాగ్నిషియం.జింకు,రాగి లోహాలలోని నైట్రైడు,కార్బైడ్., ఆక్సైడులను తొలగించి శుద్ధిచేయు ప్రక్రియలో ఉపయోగిస్తారు[4].అల్యూమినియం,ఇనుము,జింకు,టంగ్స్టన్, మోనెల్ లోహాలను అతుకుటకు సోల్డరింగు పూరకం(soldering flux)గా ఉపయోగిస్తారు.ఎలక్ట్రికల్ రెసిస్టర్సు తయారీలో సేరామికి ఆధారం మీద కార్బన్ పొరను అతుకుటకు బోరాన్ ట్రైక్లోరైడ్ ను ఉపయోగిస్తారు.అలాగే అధిక శక్తివంతమైన ఇంధన క్షేత్రాలలో, రాకెట్ చోదకాల్లో BTU ఉష్ణవిలువను పెంచుటకు ఉపయోగిస్తారు.అలాగే అర్ద ఉష్ణవాహకాల్లో ప్లాస్మా ఎట్చింగ్(plasma etching)గా బోరాన్ ట్రైక్లోరైడ్ ను ఉపయోగిస్తారు.సేంద్రియ పదార్థాల సంశ్లేషణలో బోరాన్ ట్రైక్లోరైడ్ ను కారకంగా ఉపయోగిస్తారు.ఇది బ్రోమైడ్ వలే ఈథర్సులోని కార్బన్-ఆక్సిజన్ బంధాని చీల్చుతుంది.
ఇవికూడా చూడండి
[మార్చు]మూలాలు/ఆధారాలు
[మార్చు]- ↑ "Boron trichloride". sigmaaldrich.com. Retrieved 2017-04-21.
- ↑ "Physical Properties for Boron Trichloride". airproducts.com. Archived from the original on 2017-08-24. Retrieved 2017-04-21.
- ↑ 3.0 3.1 "BORON TRICHLORIDE". pubchem.ncbi.nlm.nih.gov. Retrieved 2017-04-21.
- ↑ "Boron Trichloride". c-f-c.com/specgas_products. Archived from the original on 2017-05-11. Retrieved 2017-04-21.